これからは、最近の検査動向に関する知見について紹介したいと思います。今回は、興味深いバイオマーカー探索技術に関するPNAS論文の報告ありましたので、簡単に内容を紹介します。
(A)前置き;
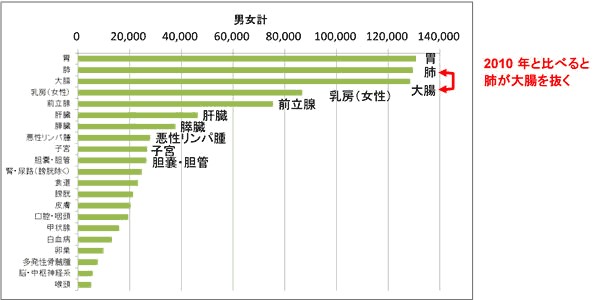
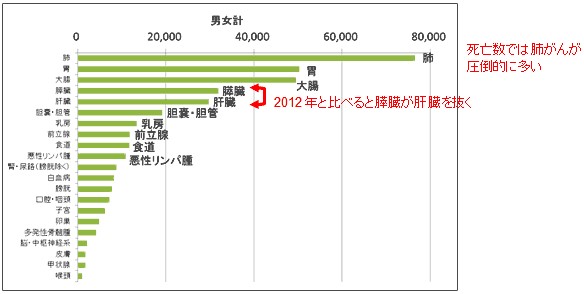
・膵臓がん(PDAC)は早期診断が困難で、転移しやすく、さらに化学療法や放射線治療が効きにくいことから、膵がんに罹る患者数と死亡する患者数がほぼ同じといわれており、国立がんセンターの報告(2014年、図1)*1では、毎年4万人近くが罹患し、3万人以上の患者が膵がんで亡くなっております。日本での治療は外科的切除、補助化学療法および放射線療法がありますが、膵癌はしばしば診断時に進行癌であるので、予後は不良といわれています。日本膵臓学会の20年間の治療成績による5年生存率はステージⅡ:44%、ステージⅢ:24%、ステージⅣa:11%、ステージⅣb:3%となっています。
・米国では、現在の5年生存率は5%と低く、手術後に80%に転移がみられ、手術後の5年生存率はたったの25%です。2030年までに、すい臓がんによる年間死亡原因はがんで4番目になりそうです。
・すい臓がんは治りにくい難治性がんで、40歳代から70歳代の中高齢者に多く発症し、今後ますます増加する傾向にあります。最近、元東大脳研神経内科教授の金沢一郎先生が、すい臓がんで逝去(74歳)されました。筆者もかってお世話になったことがあり、亡き先生のご冥福を心から申し上げる次第です。
*PDAC(Pancreatic ductal adenocarcinoma);膵管腺癌;(注;膵がん;臓器から付いた名称、腺がん;細胞の種類から付いた名称、膵がんのほとんどが腺がん)。
図1、2014年のがん統計予測
罹患約88万人、死亡約37万人と推定*1
膵癌の罹患数(新たに診断された患者数)
死亡数
・膵がんの検査の現状*2
(1)膵がんの腫瘍マーカーの測定
CA19-9、Span-1、Dupan-2、SLXなどの腫瘍マーカーがありますが、進行性膵がんを除くと、これらマーカーの陽性率は一般的に低く、そのサイズが2cm以下でのCA19-9陽性率は50%程度に過ぎない。また、CA19-9は早期すい臓がんで異常値を示さない例が多くあり、早期検出にはあまり役立っておりません。しかし、CA19-9はすい臓がん患者の生存期間と相関しており、すい臓がん切除後の再発診断には有用との報告があり、経過観察には重要なマーカーとなっています。
(2)膵がんの画像診断
診断はCTを使いますが、望ましい検査は腹部ヘリカルCTまたは膵臓のMRI(MRCP)があります。CTまたはMRCPによって切除不能、又は転移性の病変が見つかった場合には、組織診断のために経皮的針吸引をすることがあります。
*1;国立がんセンター;http://www.ncc.go.jp/jp/information/press_release_20140710.html
*2;日本消化器病学会;http://www.jsge.or.jp/citizen/2005/43kyusyu.html
――――――――――――――――――――――――――――――――――――――――
(B)すい臓がんイメージ画像による診断のためのイムノコンジュゲート;
論文;PNAS, 112 (52) 15850-15855,2015
著者;Houghton, et.al.
所属;Memorial Sloan Kettering Cancer Center, NY
タイトル;Site-specifically labeled CA19.9-targeted immunoconjugates for the PET, NIRF, and multimodal PET/NIRF imaging of pancreatic cancer.
.http://www.pnas.org/content/112/52/15850.full.pdf
・ニューヨークのSloan Ketteringがん研究所のHoughtonらは、すい臓がんにおける、ステージ別、モニタリングおよび治療への手助けとなる適切な分子イメージング装置は未だないとの認識の下、すい臓がんである膵臓腺菅癌(PDAC)のイメージング検査に用いるユニークなイムノコンジュゲート(標識化抗体)を開発しました。PDACマウスモデルにおいて、PETならびに近紫外蛍光イメージング(NIRF;Near‐infrared Fluorescent)診断に、イムノコンジュゲートを用いて前臨床的な評価を試み、臨床使用の可能性に向けて一定の成果を挙げているようです。
◆イムノコンジュゲートの作成;
PETはイメージング診断の有望な方法ですが、FDA承認されたイメージング試薬として18FのD-グルコースのFDGがあります。 しかし膵癌の原発巣では7mm、肝臓転移では1㎝以下のサイズでの画像は不明確で、かつBenignと悪性とを識別する検査としては不十分であるらしい。
そこで、画像の感度を上げるため、ヒトPDACの90%以上で大量に存在する腫瘍マーカーCA19.9抗原に対するモノクローナル抗体5B1を利用して、ケイ光色素/NIRF色素あるいは放射性同位元素/Zirconium-89(89Zr)、および89ZrとNIRF色素の両方(二重様式)で5B1抗体を標識化した3種類のイムノコンジュゲートを作製し、その性能を検討した。
・標識系の構築;
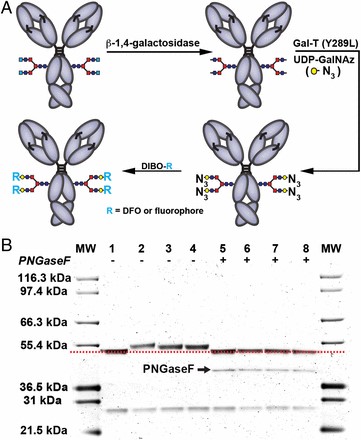
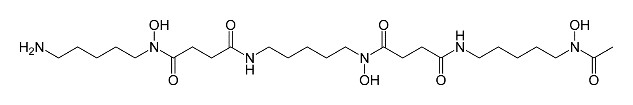
図2は免疫標識体であるイムノコンジュゲートの作成法で、抗体(CA19-9モノクローナル抗体;5B1)の長鎖にある糖鎖部位へ特異的に化学修飾されることで標識されます。この標識化における部位特異的な化学反応系を図3に示します。
図3;標識化における化学反応; orthogonal chemistry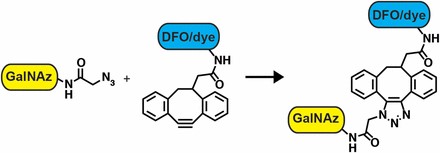 |
UDP-GalNaz;azide-bearing galactose sugar
DIBO;dibenzocyclooctyne |
・イムノコンジュゲートの特性;
表1に3種類のイムノコンジュゲートの特性を示した。89ZrとNIRF色素の両方を標識した抗体を89Zr-Dual-5B1(二重様式)としている。最も良好な結果を示したのが、このDual-5B1であった。
部位特異的な標識化が出来ていることは図2のSDS-PAGEによって確認されており、イムノコンジュゲートの抗体の特異性は腫瘍細胞株BxPC3に対する結合アッセイによって、FL-5B1;88.8nM、Dual-5B1;51nMと、ナノモルレベルの親和性が保持され、担保されている。
*参考;5B1抗体は結合定数=0.14 nmol/L(Clin Cancer Res 17,1024,2011)
◆結果;部位特異的な修飾によって、免疫反応性が保持されているイムノコンジュゲートが作製できており、これら3種類のイムノコンジュゲート(Zr‐5B1、FL(NIRF)‐5B1、Dual‐5B1)を用いて、PDACモデルマウスで、PET、NIRF、及び二重様式のPET/NIRFによるイメージング画像を検討し、高画質なすい臓がんイメージが得られている(図4、図5)。3種類の中では、Dual-5B1がすぐれており、臨床使用に有用と示唆している。今後、これらのイムノコンジュゲートが分子イメージングツールとして、キット化の核になりうる可能性を示し、PDAC患者の症状改善の支援となりうることを指摘している。
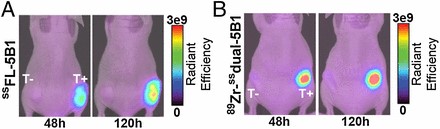
・Invivoでのイメージング画像;
ヒト膵臓腺癌由来のCA19.9陽性細胞/BxPC3及び、CA19.9陰性細胞/M IAPaCa‐2をそれぞれ、マウスの左右皮下にゼノグラフト(異種移植)し、約3週間後に各標識抗体試薬をマウス尾静脈から注入し、48h、120h後にPET/CTスキャナーでイメージ画像を観察した。その結果が図4で、CA19.9陽性のBxPC3腫瘍の平均ケイ光強度はCA19.9陰性細胞のM IAPaCa‐2腫瘍に比べて約18倍強く、さらに器官対腫瘍での比は25:1であり、二重標識抗体Dual-5B1が優れていた。
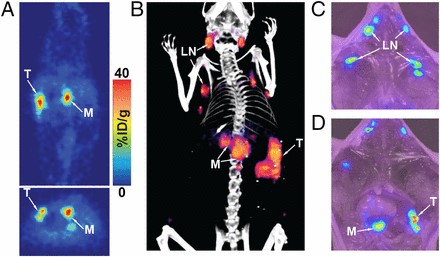
・転移モデルの実験;
すい臓に接種すると血液中にCA19.9を放出し、転移する特性をもつヒトすい臓癌の腫瘍細胞Suit‐2を移植したマウスモデルでの実験では、Dual-5B1を注入したPET/CTイメージング観察の結果が図5であり、図5AのPET画像では、原発巣;T、転移巣;M及びリンパ節へのDual-5B1取り込みがみられた。図5Bの解剖学的な骨格にPET/CTデータを描写したPET/CTイメージング画像では、2つの転移巣;Mがみられている。図5Cおよび5DのNIRFイメージング画像においては、腹腔内を開腹した画像Cではリンパ節転移の局在がみられ、リンパ節除去後の拡大画像Dでは、リンパ節除去後に残っている原発巣や転移巣がみられる。
・このような結果をもとに、イムノコンジュゲートDual-5B1を使用したNIRFイメージングは、ステージイング、治療計画およびPDAC切除する際のガイドとして使える可能性を示しており、肉眼やPETイメージングで観察できない小さな転移巣を除去するには、特に有効なプローブになり得ると結論づけている。
========================================
参考;赤外分光法の原理;
・物質に赤外光を照射し、透過光または反射光を測定することによって、物質の構造解析や定量分析する方法。
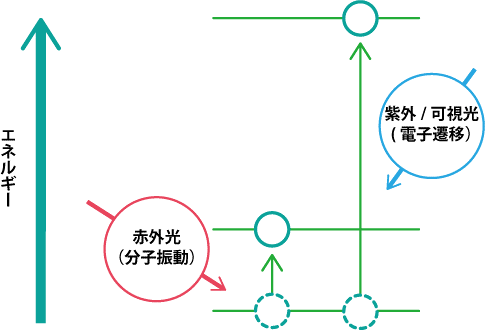
・紫外・可視光(波長0.2~0.78µm)は電子遷移による光吸収であるが、赤外光(波長2.5~25µm)は電子遷移よりエネルギーの小さな分子の振動や回転運動に基づく吸収光である(下図)。
図、赤外光の吸収;
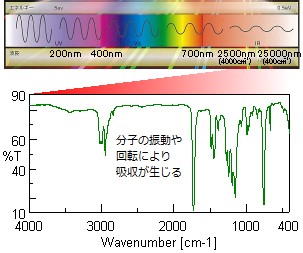
分子の振動や回転の状態変化に必要なエネルギー(赤外光波長)は、化学構造によって異なり、吸収された赤外光を測定することによって化学構造や状態に関する情報が得られる。赤外分光光度計は分散型とフーリエ変換型があり、横軸に波数(波長)、縦軸に透過率(吸光度)をプロットしたグラフを出力する。