今回は、癌のバイオマーカーについて報告されたPNAS論文を紹介します。
・酵素の活性ペプチドを利用した癌のバイオマーカー;
―数学的フレームワークをベースー
・論文;PNAS 112 (41) 12627-12632,2015.http://intl.pnas.org/content/112/41/12627
・著者;Gabriel.,et.al.
・所属;Institute for medical engineering & science, Harvard-MIT health & technology,MIT
・タイトル;Mathematical framework for activity-based cancer biomarkers
◆癌のバイオマーカーについて;
・がんの臨床的マネジメントは、治療対象となるがんのステージにおいて、(1)新しいバイオマーカーの発見、及び(2)マーカーを超高感度に検出できる技術に依存していおります。しかし早期ステージで検出できるようながんバイオマーカーは、現状では欠落していると考えられています。
・腫瘍はその大きさが直径1~2㎝になるまでの期間は、血液では検出できない状態にあるといわれております。従って、検出感度を増すためには、前述した超高感度な診断プラットフォームの開発、あるいは固形癌に由来する腫瘍マーカーの産生量を増やす方法を開発することになります。本論文では、これまでの量をベースとした検出方法に対して、活性をベースとしたプローブ開発に着目し、疾患に関連する酵素を基調とした強いシグナルを産生させることによって、達成できるとした方法について報告しています。
・本論文の著者はMITグループのGabrielらで、彼らは膜酵素であるタンパク分解酵素;MMP(matrix metalloproteinase)の脱調節が多くの癌細胞の浸潤や転移に関わっていることに着目し、癌の転移巣で活発なMMP9酵素の活性を利用したがんの検出法を開発しました。それは酵素MMP9の基質となるシグナルを付与したペプチドプローブをナノ粒子に付け、がんの局所に在るMMP9によって分解されて尿中に排泄されるシグナル付ペプチドを高感度に検出する方法です。
・ところで、直径1~2cmサイズの腫瘍/癌の転移巣は検出が難しいといわれながらも、CTやMRIなどイメージ画像によるサーベイランスに使われております。新生腫瘍が1~2mmのサイズでは、血管新生のスイッチとしてVEGFリガンドの活性化が起きるためにMMP9酵素が発現しており、この活性を調べることによって、画像イメージングの検出限界より、さらに小さな腫瘍を検出できる可能性が指摘されています。
・特異性と感度を決めるクリティカルなパラメーターに数学的モデルを用いた酵素の活性をベースとした方法は、標準的なケアよりも早期に疾患進行を予測できる新しい臨床方法と位置づけており、尿中の疾患由来シグナルを増幅させる活性プローブとして合成バイオマーカーをもちいている。 数学的フレームワーク(下記の参考欄を参照)を確立し、タンパク分解酵素の基質を結合させたPEGコアのナノ粒子(サイズ調節可能)を作成して、大腸がん(CRC: colorectal cancer)のマウスモデルで、このナノ粒子の有効性を検証している。
<以下に概要>
・ナノ粒子の作成;PEG(polyethylene glycol)鎖8本をコアとするナノ粒子(PEG-NP)に、プロテアーゼによって切断可能なペプチド配列を結合させた複合粒子を作成(図1A)。*理論的には直径5㎜サイズの腫瘍が区別(検出限界の感度)できるキャパシティをもつ検出系
・合成バイオマーカーを結合したナノ粒子の特徴;PEG‐NP表面にペプチド結合したナノ粒子(図1A)は直径が5nm以内でPEG8本のアミノ末端をもち、かつ、そのアミノ末端に基質ペプチドを結合させている。その水和(ハイドロダイナミック)半径は糸球体のポアサイズを通過でき、比較としたnanowarm(NW)の直径30nmより小さく、3~10nmサイズであり、分子量は各々10、20、40Kdの3種類の粒子を調整した(図1B)。40Kdのナノ粒子は、尿中への透過はほとんど見られていない(図1C)。
・基質ペプチドの選択;PEG‐NPに結合させるペプチド配列は、MMP9の基質として6アミノ酸残基;PLGVRGを含む2種類を作成した。1つはQ1で、MMP基質の配列を持ち、そのN末端に蛍光色素をもつ合成ペプチドである。もう1つはF1(Glu-Fib)で、MMP基質の配列を持ち、かつタンパク分解抵抗性のフィブリノペプチドBを含む、生物学的に不活性な合成ペプチドである。
- ペプチド基質Q1及びF1の構成;
Q1=5FAM‐GGPLGVRGVRGKK(CPQ-2)‐PEG2‐C;40Kd粒子へ結合
F1=eGvndneeGffsarkGGPLGVRGC;
―――――――――――――――――――――――――――――――――――
*Q1;FAM;N末端蛍光体、CPQ-2;内部クエンチング、PLGVRGV;基質ペプチド、C;カルボキシル末端Cysteine残基で、このチオール基媒介によって40Kdへカップリング。
*F1;eGvndneeGffsar;Glu-Fibでタンパク質分解酵素抵抗性のアイソマー。PLGVRGC;基質ペプチド
☆;VT750;蛍光色素
Q1及びF1をMMP酵素での基質となりうるかの実験に供し、それぞれの酵素活性を検討した。
・Q1基質によるMMP9活性では、反応の進行とともに蛍光が増加するが、酵素阻害剤Marimastatを加えると反応が停止する(図1D)。
・F1-PEGナノ粒子を投与すると、比較のコントロールマウスに比べ、膀胱内での強い蛍光が観察され(図1E)、ぺプチドが酵素によって分解された結果を示している。
*大腸がん/LST174T細胞をマウスに皮下注入し2週間成長させてから投与。
図1;尿検体を用いたがんの検出;合成バイオマーカーとしてのPEGナノ粒子
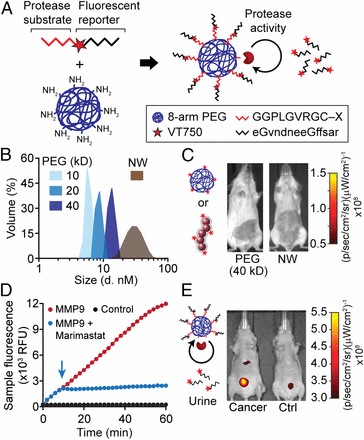 A; MMP感受性の基質(赤部位)と蛍光標識レポーター(黒部位)からなる合成ペプチド、ナノ粒子(NP)のコアであるPEGへ結合したペプチドコンジュゲート。蛍光標識レポーター(赤星;VT750)を含むぺプチドはプロテアーゼによって切断され、PEGコアから放出される。
A; MMP感受性の基質(赤部位)と蛍光標識レポーター(黒部位)からなる合成ペプチド、ナノ粒子(NP)のコアであるPEGへ結合したペプチドコンジュゲート。蛍光標識レポーター(赤星;VT750)を含むぺプチドはプロテアーゼによって切断され、PEGコアから放出される。
B; PEG(青3種)とNanowarm(NWs;褐色)のDLS解析による粒子のハイドロダイナミック直径の分布。
*DLS;動的光散乱(dynamic light scattering)
C;健常マウスのイメージ画像;膀胱でほとんど除去されない。40kDaのPEG粒子(左)とNWs(右)を注入後の蛍光観察。
D;Q1PEG粒子のインキュベーション後の基質の加水分解反応のキネティクス。MMP-9(赤)、MMP-9+Marimastat(青)、或はPBSコントロール(黒)。
*矢印はMarimastatを加えた時間、RFU;相対的蛍光ユニット。
E;F1-PEG注入後の腫瘍マウス(左)と健常マウス(右)の蛍光イメージ画像;腫瘍ママウスでは、高い尿蛍光を示している。
―――――――――――――――――――――
Q1PEG;40kDa蛍光PEG粒子
F1PEG;MMP酵素抵抗性ペプチドを含むPEG粒子
◆早期がんの検出
<系>;定常状態ODE(Steady state ordinary differential equations)モデル;
・CRCの血中バイオマーカーとしてCEAに定常状態ODEモデルを適用すると、この定常状態でのCEA濃度は腫瘍における産生速度と循環するCEAの半減期(t/2)に依存している。
・条件;平均の細胞数;106cells/mm3、retention rate=90%,、t/2=72h、産生速度の最少値;t/2min=15pg/106/10day、最大値;t/2max=260ng/106/10day
*ヒトCRC細胞24例の平均値
<結果>
①定常状態モデルによる予測;10㎜以下の腫瘍ではCEAレベルが健常者のベースライン以下の値を示し(図2Aのグレイゾーン;5㎜サイズ腫瘍)、識別不可能であるが、しかし、腫瘍サイズが10㎜、20㎜及び50㎜では、腫瘍がバイオマーカーを産生する速度が、それぞれ10%、32%、60%以内であれば識別可能となる(図2A;最少▲、最大■)。
②LS174T腫瘍細胞の10㎜サイズにモデルを適用;平均のCEA濃度より100倍高いシグナル産生がみられる(図2B)。合成プローブによる測定では、尿中シグナルが観察され、一方で血中のCEAレベルは低下する。従って、CEAの分析に比べて、より早期に、かつ高い値(数μM)でもって予測できることになる。
③本モデルによる5㎜サイズでの固形腫瘍についての理論的な予測;
現在、腫瘍の測定限界は、CTで~1㎝、血中バイオマーカーで1~2㎝サイズであり、これらの限界以下となる検出感度として、5㎜サイズ腫瘍を選択して、MMPの産生速度をヒトCRC細胞4例で調べた。
MMP9の分泌は1.9pgから12.5pg/106cells/ dayであった。MMP9酵素の濃度は、細胞数を106cells/mm3、retention rate=90%と仮定して計算すると、0.4から2.7nM(図2C;グレイボックス)の範囲であった。NPドーズ、腫瘍で産生されるMMP酵素の濃度に依存した尿中シグナルが、ELISAで容易に測定できる(~7μM/図2C;赤ドット)。
・最少検出感度10pMを用いて5㎜腫瘍(図2C、グレイボックス)に達するまで酵素濃度を下げて、実験式にフィットする値(赤)は検出限界以下で、検出できることになる(図2C青ドット)。
④数式モデルの腫瘍酵素と透過係数(Ktumor/cat, KNP/tumor)を10倍にして、合成バイオマーカー形式を10倍改善すると、感度は著しく増加した(図2D)、同様に100倍改善すると最大に達する(図2E)。本研究の数式モデルによって、5㎜サイズの腫瘍を検出することが可能であり、合成バイオマーカーによって高感度に測定ができる可能性が検証できたことになる。
図2;がんの超高感度検出するための予測モデル;
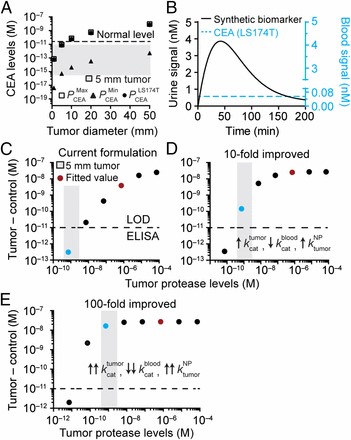 A;腫瘍サイズとCEAレベル(定常状態)との相関;10mm以下の腫瘍でのCEAのレベルは健常患者以下((点線レベル;5ng/mL)。
A;腫瘍サイズとCEAレベル(定常状態)との相関;10mm以下の腫瘍でのCEAのレベルは健常患者以下((点線レベル;5ng/mL)。
B;合成バイオマーカーナノ粒子投与後の尿中シグナル;血中CEA(定常状態)の濃度を越えて増える。
C;直径5㎜の腫瘍を検出するための合成マーカーナノ粒子の使用例;
・ELISAの検出限界(点線)、タンパク分解酵素の推定範囲(灰色ゾーン)、尿中の検出シグナル(ドット)。青点は5㎜以下のヒト腫瘍における理論的検出シグナルで、最少検出限界以下。
D;検出限界を超えて検出する合成バイオマーカーナノ粒子を10倍改善した形式による値
E;100倍改善した形式による値
◆まとめ;
MMPはがん浸潤や転移にかかわっており、多くの転移はMMP活性に依存している。腫瘍の種類が分かっているとき、原発巣が切除されており、血管新生に際してMMP9がVEGFリガンドを活性化して、画像イメージングでは検出限界となるような、より小さな新生腫瘍をMMP9の超高感度な検出よって診断できるかもしれないことが本研究の結果より明らかにされた。
・感度に加えて、がん種に特異的診断の開発には、550にも上るタンパク分解酵素の多重ライブラリーが必要となり、特異性が今後の課題となる。
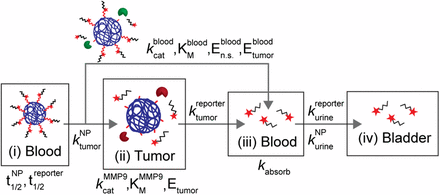
◆参考;数学的モデル(下図;省略)
定常状態ODE(Steady state ordinary differential equations)モデル;
Multicompartment model for synthetic biomarkers. Synthetic biomarkers sense tumor protease activity to produce detection signals in urine. After i.v. administration, synthetic biomarkers diffuse into the tumor (kNPtumor ) and are cleaved by tumor-associated proteases (e.g., MMP9) according to Michaelis−Menten kinetics (kMMP9cat , KMMP9M ). The cleaved reporters then diffuse back into blood, where they combine with reporters produced from nonspecific proteases (kbloodcat , KbloodM , and Ebloodn.s. ) and secreted tumor-associated proteases (Ebloodtumor ). A fraction of the reporters are reabsorbed by the kidneys (kabsorb ) before clearance into urine (kreporterurine ). See SI Text for derivation of model equations.