今回は、細胞表面のpHを検出する技術に関して最近の知見―[がんなど疾患組織およびex vivo検体の細胞表面のpH測定]―を紹介したいと思います。
―[がんなど疾患組織およびex vivo検体の細胞表面のpH測定]―
論文;PNAS,113(29,8177-8181,2016.
著者;M. Anderson et.al.,
所属;Physics Dep., University of Rhode Island,Dep. Molecular Biophysics & Biochemistry, Yale University
タイトル;Probe for the measurement of cell surface pH in vivo and ex vivo.
http://www.pnas.org/content/113/29/8177.full
<前置き>
・細胞外の酸性度(Acidity)は、がん、虚血性脳卒中、神経障害、てんかん性発作、炎症、感染症、傷害など、種々の病理学的状態の進行度合いを反映している。それら疾患の理解と治療戦略においては、正確で、かつ精度があって、時空間的に高い解像度を伴う情報が重要となる。 そこで培養細胞や動物モデル、ひいてはヒトにおいて、細胞表面でのpH測定ができれば、疾患状態を知るうえで役立つ情報になるかもしれない。
・細胞外のアシドーシスはグルコース取り込みの増加とその代謝に端を発しており、Warburg効果として知られている。強いグリコリシス(解糖)の進行は、細胞性の乳酸とプロトンを生じるが、それらは細胞内のpHを中性に保つために細胞外へ放出される。
・がん細胞では、その表面で発現される炭酸脱水素酵素が、速い代謝活性を示す結果、CO2を産生し、がん細胞周辺の酸性度増加に寄与している。転移性がん細胞、即ち、より酸性の腫瘍では、高い攻撃性と転移性を示す。細胞外の空間での酸性化は腫瘍の進行だけでなく、虚血性ストローク、炎症、感染症などの病理的状態にも関与している。
・このように、がん細胞を囲む外部pHによって、細胞膜に逆向きのpHグラジエントが形成されることになる。健康な組織の細胞外pHに比べて、がん細胞周辺のバルクの平均pHは0.5~0.8ユニットほど低い。そのpHは細胞表面で最も低く、細胞膜からの距離とともに増してゆく。
現在、細胞表面のpH測定には、次のような核磁気共鳴法と光学的イメージング法など4つの方法がある。
- インビボで、組織のpH変化をモニターするのに、磁気共鳴スペクトロスコピー(MRS)とMRIが使われており、高く極性化された13Cのバイカーボネートなど、内在性および外来性の核MR活性物質を用いて測定されている。
- 光学的アプローチが培養がん細胞の表面pHの研究につかわれている。ヘテロジニアスな微細環境下にある腫瘍は個々のがん細胞の挙動をモニターする蛍光イメージングの使用が試みられている。しかし、大抵の場合、pH感受性因子は、血液、器官や組織全体に分布する小分子であって、速やかに体外に排出されてしまう。
- ナノ粒子、バクテリオファージ粒子などのナノキャリアを使う方法では、細胞のエンドサイト―シスによって細胞内に容易に取り込まれてしまい、ほぼエンドソーム内のpHとなってしまう。
- さらに、抗体やリセプター標的ペプチド分子の使用は、プローブが細胞内化したり、細胞表面からの取り除かれてしまう。
いずれも、空間解像度に限界があって、細胞レベルでpHを測れていない。このような課題を克服して、個々の細胞表面のpHを測定するには、細胞膜表面の近くに局在するpH感受性プローブが必要である。
<本研究の目的>
・ロードアイランド大・物理学部/エール大学・分子物理生化学部のM Andersonらは、in vivo疾患組織およびex vivo検体中にある細胞表面のpH測定のため、細胞膜の表面に局在できるプローブを工夫・開発し、がん細胞表面でのpH測定を試みた。
<細胞膜への挿入ペプチド;pHLIP(pH low insertion peptide)>
・pH感受性の膜結合型プローブはリピドや脂肪酸との複合体(コンジュ―ゲート)として作られ、細胞レベルでのpH測定に使われています。しかし、このようなコンジュ―ゲートは通常、疾患組織の細胞にとって選択的ではなく、また細胞膜にも取り込まれたり、さらには、プローブがリピド交換によって反転したりする。このように、膜に組み込まれたりすることが容易に起って、特にインビボでの正確な局在性を同定することを難しくしている。
・本研究では、細胞表面でのpH測定用プローブとして、細胞膜に局在できるpHLIPペプチドファミリーの特性に着目している。このペプチドはpH依存性様式でもって、細胞膜を横切って、アミノ末端側を細胞の外に晒し、そのカルボキシ末端側を細胞質内に挿入する性質を有している。このpHLIPペプチドの分子機構は、そのAsp/Glu残基(D/E)へのプロトン付加に基づき、ペプチドの疎水性を増したフォールディング構造で、膜透過性のへリックス(transmembrane helix)を形成してペプチドを膜内へ挿入する。
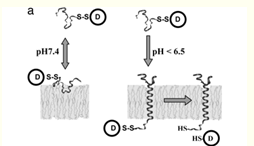
このpHLIAペプチドによる膜内挿入は、Yale大のReshetnyak YK*1らによって示され、報告されている(図1)。
図1、pHLIPペプチド(膜内挿入とトポロジー);
ペプチドと薬剤Dをコンジュゲートした複合体を、生理的pHで、細胞膜(リポソーム膜)に加えると、弱い相互作用で膜表面に結合する。pHを下げると、複合体ペプチドが細胞質に挿入される(C末端側で膜貫通へリックスを形成して貫入)。細胞質内で、ペプチド内ジスルヒド結合が還元されて、薬剤Dがリリースされる。
*1;PNAS,103(17):6460–6465,2006.
・本研究で用いた新たなプローブとして作成したペプチドは、蛍光色素をペプチドに結合させたSNARF-pHLIPコンジュゲートであり、以下に示す。
<pH依存性に膜局在するプローブの構成>
pHLIP(pH low insertion peptide)は、pH低下によって膜内へ挿入(insertion)するペプチドファミリーの一群で、今回使用したペプチド配列を次に示す。前述したように、ペプチド内のC末端側のD/E(赤)がプロトン化されて疎水性が増す。
配列;Ac-AKEQNPIYWARYADWLFTTPLLLLDLALLVDADEGT
・pHLIPのプローブ化は、pH感受性の蛍光色素SNARF(Seminaphtharhodafluor)をpHLIPペプチドのLys残基(K)のNH2基に結合させる。
蛍光色素;SNARF(Seminaphtharhodafluor)の構造式
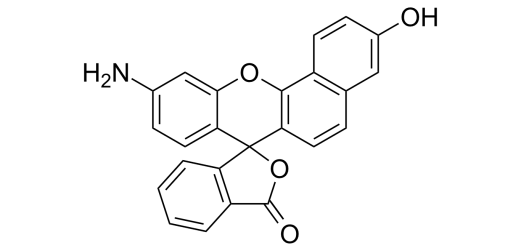 ・吸光係数;548 nm, ε548 = 27,000 M−1 cm−1.
・吸光係数;548 nm, ε548 = 27,000 M−1 cm−1.
・pH6.0でのcarboxy-SNARFの蛍光の極大ピーク;585 nm。
・pH9.0での極大ピーク;640 nm (図3A参照)
<細胞表面でのpH変化の観察>
・pH感受性のSNARF-pHLIPコンジュゲートを用いて、細胞膜表面のpH変化の観察(図2)。対象とした腫瘍細胞は転移性の高い腫瘍細胞HeLa、ならびにメラノーマ細胞では、高い転移性のM4A4と非転移性のNM2C5細胞を用いた。
・in vitroで培養し、スフェロイドに成長したHela細胞塊を用いて、培養スフェロイド腫瘍を顕微鏡のグラス上で観察、pH6.6でSNARF-pHLIP処理されたときのケイ光(図2A、2B)は、消光剤DAPI*2を加えることで、細胞表面での蛍光が消光され、核内へのコンジュゲート移行もみられなかった(図2C)。事実、膜非透過性のトリパンブルー(TB)処理したHela細胞では、細胞表面に局在するSNARFの蛍光(TB処理前/図2D)は消光(TB処理後/図2F)されており、SNARF-pHLIPが細胞表面上に局在することが示唆されている。
*2:DAPI(4′,6-diamidino-2-phenylindole);DNAに強力に結合する蛍光色素、蛍光顕微鏡観察に広く利用。
図2、腫瘍スフェロイドのイメージとトリパンブルーアッセイ;
・pH6.6でSNARF-pHLIP処理;emission filters波長;580nm (A) 、640nm (B)
C;細胞核を染色するためにDAPI*2処理したスフェロイド(colors are artificial; 10× 対物レンズ).
D、E; HeLa細胞のスフェロイド腫瘍のSNARF-pHLIPイメージ;トリパンブルー処理前(D)後(E);emission filter 580nm
F;SNARF-pHLIP–処理したHeLa細胞のスフェロイド腫瘍のトリパンブルー処理前後のスペクトル
<リポソームでのSNARF-pHLIPの蛍光スペクトルの観察>
・次に、膜成分としてリポソーム(POPC*3)を用い、リポソームをSNARF-pHLIP処理した時の蛍光スペクトル変化を調べた(図3)。
図3Aに示すように、SNARF-pHLIPの蛍光スペクトルはpH5.9~7.8の間でpHに依存して変化する。低pHでの蛍光スペクトル極大は595 nmであり、高pHでの蛍光極大波長は645 nmであった。その極大波長の比、即ち595/645 nmの比は、pH変化と相関性がみられ、キャリブレーションを行い(図3B)、蛍光波長比とpHとの間には、次式(1)で示す関係が得られた。
*3; POPC;1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine
pH=(8.459±0.031)−(1.223±0.024)×ratio595/645 式(1)
・このpHと蛍光波長比との関係を、スフェロイド腫瘍に成長した3種類のがん細胞を用いて、2デオキシグルコース(2DG)*4存在下で蛍光を調べた。図3Cにみられるように、3種類のHela、M4A4およびNM2C5細胞ともに同じ蛍光波長比(595/645nm)を与え、(1)式の関係が成立つことが確認された。
・プロトン代謝を促進するグルコース存在下では、HeLa, M4A4および NM2C5各細胞ともに、周りのバルクpH7.5に対し、その細胞表面のpHは7.0を越えなかった。バルクpHが6.4以下の場合には、バルクpHと細胞表面pHとは平衡状態にあった(図3D)。
*4;通常の酸素濃度において、腫瘍細胞は高いグルコース取り込み能(Warburg効果)を示す結果、細胞質内プロトンレベルが上昇し、乳酸の産生が上がる。しかし、2DGは代謝されないので、がん細胞からのプロトンのリリ‐スの影響は受けないと考えられる。
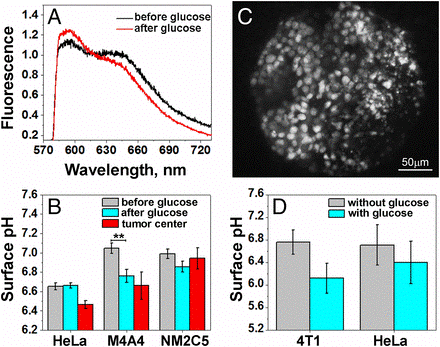
図3、腫瘍スフェロイドのがん細胞表面のpHとキャリブレーション
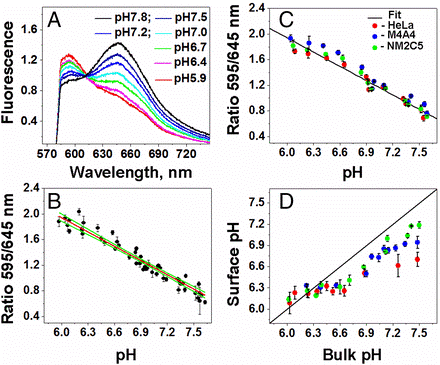 A; SNARF-pHLIP処理したPOPCリポソームのpH変化とそのエミッションスペクトル
A; SNARF-pHLIP処理したPOPCリポソームのpH変化とそのエミッションスペクトル
B; SNARF-pHLIP処理したPOPCリポソームのキャリブレーション曲線(赤線)と95%信頼区間(緑線)、各pHでの595/645ケイ光比(黒点)。
C;SNARF-pHLIP処理しHeLa, M4A4, and NM2C5各細胞ベース(50 mM 2-DG存在下)でのキャリブレーションとpH。
D;50mMグルコース存在下でのスフェロイドの結果。
*POPC;1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine
・in vivo及びex vivoマウス実験では、腫瘍サイズが5~8㎜にまで成長させてから検討した(図4)。腫瘍組織のpH測定において、腫瘍細胞表面での酸性度;0.3ユニットのpH差は統計的に有意な値であった。
・in vivoでは、酸性化の度合いは、転移性M4A4細胞腫瘍で顕著であったが、非転移性のNM2C5細胞腫瘍ではみられなかった。各腫瘍の中央部にある細胞の表面平均pHは、Hela細胞;pH6.5±0.2、M4A4:pH6.7±0.5、NM2C5:pH6.9±0.3であった(図4B)。Hela及びM4A4腫瘍ともに、pHが6.0~6.1の低い表面pHを示した領域も幾つか観察されている。
・ex vivoでは、各細胞腫瘍をSNARF-pHLIPで1時間処理後に、pH7.4のPBS緩衝液で完璧に洗浄後、pH測定した。転移性の高いHela腫瘍細胞では代謝活性の高い酸性表面になっている(図4C)。
・高転移性のヒトHela細胞とマウス4T1細胞表面の平均pH変化は、グルコース有無で、Hela細胞;pH6.8±0.2(無)からpH6.1±0.3(有)、4T1細胞;pH6.7±0.4(無)からpH6.4±0.4(有)であった。こうして、グルコース有り無しでのpH差はヒトHela細胞で0.7ユニット、マウス4T1細胞では0.3ユニットであった(図4D)。
図4、in vivo及びex vivoでの腫瘍におけるがん細胞表面でのpH測定;
尾部静脈からSNARF-pHLIPを投与、4時間後(125㎎グルコースをi.p.注入後)に皮膚を除き、腫瘍を取り出して蛍光測定。
B;生動物の腫瘍の細胞表面pH;
グルコース注入前後の表面平均値と注入後の腫瘍中央部の平均値。
測定回数:Hela腫瘍;グルコース注入前24回、注入後30回、腫瘍の中央部36回、M4A4腫瘍;それぞれ13回、11回、10回。NM2C5腫瘍;それぞれ16回、21回、8回。
C;HeLa細胞の典型的な腫瘍蛍光イメージ;
ex vivo;グルコース存在下でSNARF-pHLIP処理した腫瘍。
D; SNARF-pHLIP処理したHela及び4T1腫瘍の平均表面pH。
ex vivo測定回数;Hela腫瘍;グルコース投与前56回、後51回、4T1腫瘍;前35回、後31回。
A,B;in vivo、マウス腹腔内にがん細胞を注入、5~8㎜サイズまで腫瘍成長後、皮膚を除いて腫瘍を取り出して実験に供与。
C,D; A,Bと同様、腫瘍をスライスしてex vivo実験に供与。
(まとめ)
・ここに紹介された新しいプローブ;蛍光色素結合ペプチドのSNARF-pHLIPは、がん細胞の表面pHの情報を与える。特に転移性の高いがん細胞では、正常組織のバルク溶液pH7.0に対して、0.7~0.9pHユニット低い値であり、がん細胞が疾患組織で十分に浸潤している部位だけでなく、浸潤の低い組織でも検出可能であることを示している。
・がん表面の酸性度が腫瘍のステージや転移性に相関しているため、ヒトのバイオプシ―材料、血液や生体液中にあるがん細胞を用いて、その細胞表面pHの測定が可能となれば、治療選択、モニタリング、あるいは治療薬R&Dに役立つかもしれない。
・酸性疾患組織を標的として、光学的な色素ラベルしたpHLIPは、PETやSPET(シングルホトンET)のプローブとして、新たな酸性度マーカーになると考えられている。細胞の外膜表面のpHを測定するツールとして、疾患の進行度を理解することや、pHベースのイメージガイド介入の開発に貢献するであろう。
・ここで示されたヒト腫瘍を用いた、マウスでのin vivo及びex vivo実験は、ヒトへの応用には乗り越えるべき課題があり、特にこのようなペプチドをどのように、腫瘍組織へ特異的にデリバリーできるのか?、検討の余地がある。 しかしながら、バイオプシー材料などに含まれるがん細胞を用いた、in vitroでの表面pH測定は、比較的容易であり、今後の進展が期待される。
以上