今回は、⑤質量分析法MS(Mass Spetroscopy assay)について紹介したいと思います。MSは有機化学で物質の同定に古くから使われており、装置も大型なものを使用しておりました。現在ではコンパクトな小型になっており、かつタンパク質などの高分子分析にも利用されており、隔世の感が致します。基礎生化学のタンパク質分析にベースを置くプロテオミックスをはじめとして、多方面での利用がみられます。臨床面での応用も検討されており、時あたかもタイミング良く、本年、2016年のClinical Chemistry 1月号*1に臨床MSとして、MSに関する総説、レビューなどの特集が組まれておりますので、参考にして下さい。
(1)質量分析法(MS;Mass Spectrometry);
・質量分析法は分子サイズによって物質を同定する方法で、質量分析計(Mass spectrometer)を用いて分子やイオンの質量電荷比(m/z 値)を分析します。その装置は、試料導入部、イオン化部、イオン分離分析する質量分離部、イオン検出部、データ解析処理部の5つから構成されています。
◆測定原理;
・分子は真空中でイオン化され、電磁気力(電界または磁界中)によって質量電荷比(m/z 値:m質量、Z電荷)に応じて分離されるので、実際の分子の重さを測るのではなく、そのイオン種を検出することになります。横軸にm/z 値、縦軸に検出するイオン強度をとったマススペクトル(Mass spectrum)情報として結果が得られます。
・MS分析において、測定するサンプル分子をイオン化させることが必須になります。そのイオン化に電子衝撃法(EI;Electron Ionization)は古くから用いられており、気化させたサンプル分子に加速電子を衝突させてラジカル陽イオン化を発生させます(次式)。
気相反応;電子イオン化の過程;M:分子、e−:電子、M+•:イオン化分子
・この方法は簡便で、測定も容易なため分子量の低い化合物の解析に現在でもよく用いられています。しかし、難揮発性物質や容易に熱分解する化合物などは気化できないこと、さらに電子衝突の際に、多くの化合物では断片化(フラグメンテーション)してしまい、特に高分子量の化合物では有用なマススペクトル情報が得られないという課題がありました。
・タンパク質などの高分子の分析においては、タンパク質が高分子であるため気化しにくく、またイオン化に高エネルギーが必要となります。逆に高エネルギーを与えると分解してフラグメンテーションするため、容易でありませんでした。
・この欠点を克服するため、様々なイオン化法が検討され開発されてきました。そのうち、田中耕一氏が開発したマトリックス支援レーザー脱離イオン化法(MALDI ;Matrix-assisted Laser Desorption Ionization)*2~4や、米国フェン(Fenn)9博士が開発したエレクトロスプレーイオン化法(ESI;Electrospray Ionization)*5はマイルドなイオン化法で最も新しい手法であり、両者とも2002年ノーベル化学賞を受賞しました。
・これらのうち、MALDI法はソフトイオン化法とよばれ、従来、壊れやすかった生体高分子のイオン化に適しています。この手法によって分子量の大きな高分子化合物の質量分析が可能となり、医学・生物学、特に生化学分野の研究を中心に大きな発展をもたらしました。
・このサンプルのイオン化法の一つとして、新たに見いだされた、通称MALDI法はドイツのHillenkamp教授らによって最初に発明*6されたもので、分析に必要なサンプル量がごく微量で、かつサンプル純度も比較的低くて済むので生体由来サンプルの分析を容易にしており、ESI法を超えるフェムトモル(fmol)レベルでの測定も可能だと言われております。
◆MS分析の臨床応用;
・臨床面でのMS利用に関しては、MALDI-TOF―MS法として臨床診断において、分子量検出をベースとした微生物の同定や特定に関するレビュー報告*7があり、現在、多数の臨床検査ラボで、この手法が主に細菌検出に用いられており、感染診断のみでなく、変異の発見や抗細菌抵抗性の検出などウイルスによって引き起こされる感染の診断の改善につながっているらしい。この他、いくつかのアプローチが報告されています。LSD(Lysosomal Storage disease)マーカーとしてのムコポリサッカロイドのMS分析による新生児スクリーニングと診断における利用*8、Cancer Genome Atlas (TCGA)ネットワークをベースとしたClinical Proteomic Tumor Analysis Consortium (CPTAC)プロジェクトのチーム研究一環での逆相ナノLC法と組み合わせたMS分析による大腸がん診断の検討などが報告*9されています。
(2)質量分析のレーザーイオン化技術における画期的な発見;
◆発見の経緯;
・サンプルをイオン化するMALDI法は、レーザー照射によってタンパク質を気化させる方法です。 島津製作所の田中耕一氏は、その際、熱エネルギーの緩衝材となるマトリックスとして、グリセロールとコバルト混合物を使用したところ、タンパク質が気化され、そのイオンの検出に世界で初めて成功しました。この功績によって、田中氏は2002年にノーベル化学賞を受賞したのです。この発見によってMALDI開発が進み、実用化されました。
・このとき、「間違えて」グリセロールとコバルトを混ぜてしまい、「捨てるのはもったいない」と、実験したところ見事に成功しました。そのエピソードがノーベル賞講演で語られております:
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2002/tanaka-bio.html
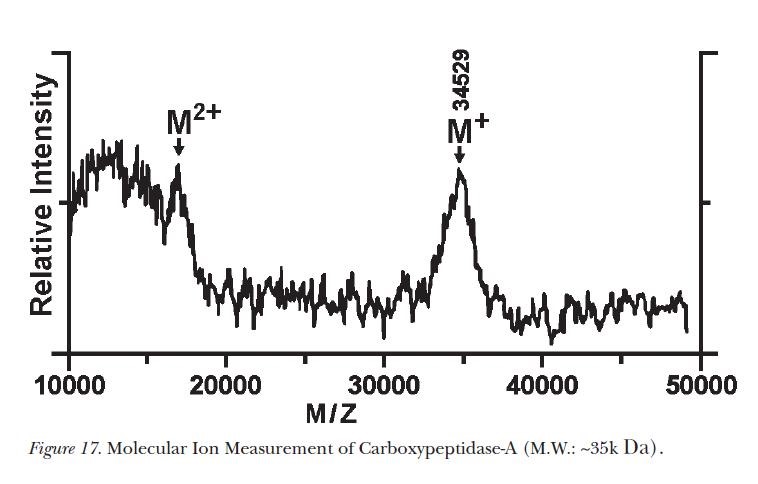
「1985年2月のある日、超微細コバルトパウダー(UFMP;Ultra Fine Metal Powder)をマトリックスとして使用しようとしたところ、間違ってグリセリンUFMPを調整してしまったが、捨てるには“もったいない”との思いから、グリセリンUFMPを用いて実験することにした。サンプルチャンバーに載せて乾燥させるとき、レ-ザ-照射すれば乾燥が早められると思ってレーザースイッチを作動させ、出来るだけ早くグリセリンが除去できたかどうかを確認しようとスペクトロメーターでモニターしていたところ、ノイズピークとは違う、これまで見たこともないシングルピーク(M+;34,529)が観察されたのです。そこで何度も実験を繰り返したが、同じピークが常に得られた」と、当時の実験の様子を語っております。このピークが高分子タンパク質を初めて検出した時のMW約35,000のカルボキシペプチダーゼAであります(図1/Fig.17)*2、10。
図1、カルボキシペプチダーゼA(MW~35,000)のMS分析*2、10
◆何故ノーベル賞受賞か?
・1985年にMALDI法を発明(Anal. Chem*6)したドイツのミュンスター大(University of Münster)のHillenkamp教授(2014年78歳で死去)らがノーベル賞の受賞を逃し、何故、日本の田中耕一氏であったのか?に関して、田中氏本人もビックリしており、世間でもドイツのHillenkamp氏が受賞できなかったのか疑問視されていたようです。
・それは、1987年5月の国内の第35回質量分析学会や、同年9月に宝塚で開催された第2回日本・中国のMSジョイントシンポジウムでの田中氏の口頭発表*2が、Hillenkampらの発表に先行していたこと、並びにHillenkamp教授が1988年に、Anal. Chem.*11のCorrespondence の中で10,000以上の高分子のMS分析に関するMALDIについて言及した際、その冒頭の中で、田中耕一がMW34,000のタンパク質を分析できていることを引用し明記されていたことから、田中氏が最初の発明者であることが明瞭となったのです。
・ほぼ同時期に発明したにも関わらず、田中氏の研究結果を引用したHillenkamp氏(写真下)には、科学の真正を重んじる姿勢が感じられて、昨今の研究不正の話題があちこちで仄聞されるなか、科学者として当たり前とはいえ、敬意を表するに値する。
―――――――――――――――――――――――――――――――――――
*1, Clinical Mass Spectrometry Achieving Prominence in Laboratory MedicineSpecial,Clin Chem 62;1,2016.
*2;Tanaka,K,et.al.,“Detection of High Mass Molecules by Laser Desorption Time-of-Flight Mass Spectrometry”. SECOND JAPAN-CHINA JOINT SYMPOSIUM ON MASS SPECTROMETRY ABSTRACT、P185-188,1987. https://masspec.scripps.edu/mshistory/timeline/time_pdf/1988_Tanaka.pdf
*3;Tanaka,K; et.al.,”Protein and polymer analyses up to m/z 100 000 by laser ionization time-of-flight mass spectrometry”. Rapid Communications in Mass Spectrometry 2 (8): 151–153,1988.
*4;特許1769145;出願日1985年8月21日「レーザーイオン化質量分析計用試料作成方法」
*5;Fenn, J. B. et.al.,”Electrospray ionization for mass spectrometry of large biomolecules”. Science 246: 64–71.1989.
*6;Karas, M.; Bachmann, D.; Hillenkamp, F. “Influence of the Wavelength in High-Irradiance Ultraviolet Laser Desorption Mass Spectrometry of Organic Molecules”. Anal. Chem. 57 (14): 2935–9. 1985.
*7;Cobo F; Application of MALDI-TOF Mass Spectrometry in Clinical Virology: A Review; Open Virol J. 7: 84–90. 2013. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3821086/
*8;Kumar A B, et.al.,;Tandem Mass Spectrometry Has a Larger Analytical Range than Fluorescence Assays of Lysosomal Enzymes: Application to Newborn Screening and Diagnosis of Mucopolysaccharidoses Types II, IVA, and VI; Clin Chem 61:11,1363-1371,2015. http://faculty.washington.edu/gelb/documents/clinchem.2015.242560.full.pdf
*9;Jimenez C R,; Proteomics of Colorectal Cancer in a Genomic Context: First Large-scale Mass Spectrometry–Based Analysis from the Cancer Genome Atlas; Clin Chem 61:9,1126-1128,2015.
http://www.clinchem.org/content/61/9/1126.short
*10;ノーベル賞講演;http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2002/tanaka-lecture.pdf
*11;Karas M, Hillenkamp F (1988). “Laser desorption ionization of proteins with molecular masses exceeding 10,000 daltons” (PDF). Anal. Chem. 60 (20): 2299–301,1988.
田中 耕一 John B. Fenn Kurt Wüthrich
◆田中耕一;1959年8月富山市で生まれ、1983年 3月東北大・工・電気工学卒、1983年 4月(株) 島津製作所入社、2002年11月 フェロー、田中耕一記念質量分析研究所 所長
◆John B. Fenn;1917年6月NewYorkで生まれ、2010年12月死去。Virginia Commonwealth University教授
◆Kurt Wüthrich; 1938年10月スイス Aarberg生まれ、チューリッヒ Eidgenössische Technische Hochschule (Swiss Federal Institute of Technology)教授、米国The Scripps Research Institute兼任
*2002年のノーベル化学賞は「2002年の生物学的高分子の同定及び構造解析の方法の開発」として3名受賞。田中耕一とJohn B. Fennは「生体高分子のMSにおけるソフト吸収イオン化方法の開発」でそれぞれ1/4の貢献度、Kurt Wüthrichは「溶液中高分子の3次元構造を決定するためのNMR法の開発」でその貢献度は1/2。
Franz Hillenkamp (March 18, 1936 – August 22, 2014)
===================================
―間違いが契機で発見された技術―その2
(3)余談;http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2000/shirakawa-bio.html
このMS分析における田中耕一氏のマトリック発明は、ポリアセチレンから電気を通す固体の合成プラスチックの発明で、2000年ノーベル化学賞を受賞した東工大の白川博士の、間違いから新たな発見に繋った研究と契機が似ており、参考までにそれを簡単に紹介したいと思います。
・白川博士の場合も、偶然の賜物によって固体ポリマーを発明したのであって、発見を見逃さない柔軟性な視点(いわゆる目利き)がいかに、重要かを示唆しているのだと思います
・1967年、東工大・白川博士の実験室でアセチレンを原料とした合成研究において、触媒(Ziegler-Natta)を溶かした溶液に、アセチレンガスを吹込み、ゆっくりとポリマー合成の反応を進行させ、通常は黒い粉末のポリマー(black powder)が得られる実験を遂行しておりました。ある時、留学生が行った実験で、偶然、金属様の銀色フィルムが得られました。 なぜフィルム様ポリマーが得られてしまったのか、その原因を検証するために、しつこく何度も検討を行い、最終的に触媒の濃度が多かったことを見出しました。原因は、その研究員が勘違いして必要量の1000倍を超える触媒を加えたために溶液表面で合成反応が一気に起こり、金属性フィルムが合成されたのでした。
・米国ペンシルバニア大のマクダイアミッド博士が、この金属性ポリアセチレンを見て驚き、白川博士との共同研究を提案し、水素を引抜くドーピング法**1によって導電性が10億倍も増加した固体ポリアセチレンが作り出され、金属とほぼ同じ能力があることを発見しました。
・2000年に電気を流せるプラスチック(ポリアセチレン)の発見によってノーベル化学賞を受賞しました:「導電性高分子の発見と開発」。 現在、この技術を利用したポリアセチレン、ポリピロールが実用化されており、金属より軽いため携帯電話の電池などに使用されております。
**1;ドーピング法;ヨウ素加えて電子を引き抜いて穴をあける方法。
Hideki Shirakawa Alan G. MacDiarmid