今回は、酸化ストレスにともなうDNA損傷と、その代謝産物における新たなバイオマーカーに関する知見;「炎症ならびに酸化ストレスのバイオマーカーになりうる尿中のDNA代謝産物」、を紹介したいと思います。
(前置き)
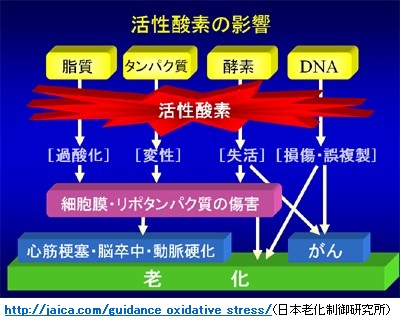
・生体成分の酸化ダメージ(損傷)は、老化現象の亢進だけでなく、糖尿病、高血圧、動脈硬化などの生活習慣病を含めたいろんな疾患の発症に密接に関連していることが明らかになりつつあります。
・このような酸化損傷は、体内で発生する活性酸素*1によってもたらされますが、ほとんどの活性酸素は抗酸化物質のグルタチオン(GSH)やグルタチオンペルオキシダーゼなどの抗酸化酵素の働きで消滅されます。しかし、過剰に発生した活性酸素によってDNA、脂質、酵素、タンパク質が酸化されます。
・活性酸素は反応性が高く、その半減期も短いので直接に測定することは難しく、従って、酸化損傷によって生じる比較的安定な化合物をバイオマーカーとして用いることで、生体内の活性酸素の状態を間接的に調べることが可能となります。
◆活性酸素と疾患
 *1;活性酸素種(Reactive Oxygen Species: ROS);
*1;活性酸素種(Reactive Oxygen Species: ROS);
・活性酸素は好気性生物の酸素消費過程で発生する副産物で、スーパーオキサイド/スーパーオキサイドアニオン(O2・-)、ヒドロキシラジカル(HO・)、過酸化水素 (H2O2)、一重項酸素(1O2)の4種類がある。
注;スーパーオキサイドとヒドロキシラジカルは不対電子をもつフリーラジカルですが、過酸化水素と一重項酸素は活性酸素ではあるがフリーラジカルではない。
■炎症ならびに酸化ストレスのバイオマーカーになりうる尿中のDNA代謝産物
・論文;PNAS,112 (35) E4845-E4853; 2015.
・著者;Jumpathong W et.al.
・所属;,Dept.Biol.Eng. MIT
・タイトル;Metabolic fate of endogenous molecular damage: Urinary glutathione conjugates of DNA-derived base propenals as markers of inflammation.
http://www.pnas.org/content/112/35/E4845.full.pdf
http://www.pnas.org/content/112/35/E4845.full
・長い間、内在性DNA損傷は炎症と酸化ストレスを伴い、病態生理学的にメカ二スティックに強くリンクしているがん疾患の有用なバイオマーカー候補とみなされてきました。しかしながら、アルキル化や酸化、脱アミノ、ニトロ化やハロゲン化などの多様なダメージ化学(damage chemistries)があり、部分的には組織で形成されているDNA損傷化合物の代謝系への理解が乏しいことによって、いまだ炎症と酸化ストレスによるDNA損傷由来の有意なバイオマーカー化合物はみつかっていない。
・さらに、尿、血液、糞便など追跡可能な成分から内在性DNA損傷の産物を特徴づける試みはなされているけれども、DNA修復後の代謝などによる損傷物質の生体内での変換(biotrasnformational fate)が不可避であって、厳密には検討されておらず、重要なバイオマーカーが見逃されていると考えられている。
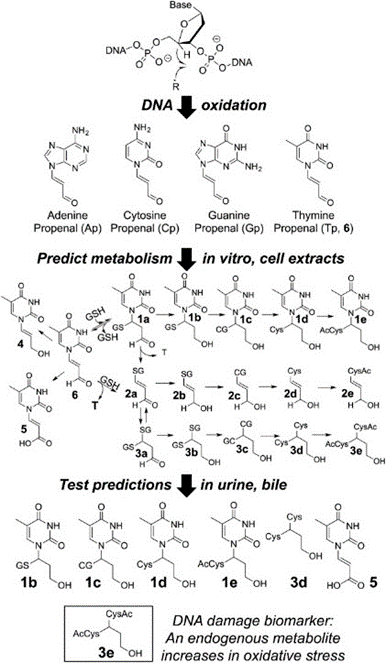
・最近、Marnett*2らが2-デオキシグアノシンの誘導体M1dGを発見した。静脈内投与したM1dG*3が肝臓のキサンチンオキシダーゼによって酸化され、6‐オキシM1dGを生じ、これが主に胆汁へ、少量が尿へ排出されている。この例をもとに、DNA酸化で生じるプロペナール(図1)の産物を用いて、内在性DNA損傷と、そのインビトロ及びインビボでの最終代謝物を予測するため、論理的で系統的なアプローチによる代謝プロファイリング(図2)を開発した。
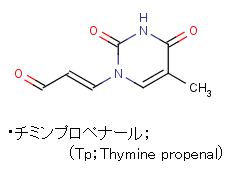
・現在、DNA由来のバイオマーカー研究は、2-デオキシリボースの酸化物、8-oxoGのような産物に焦点が当てられているが、ヒトの各細胞では、毎日、数千の化合物切断が生じており、2-デオキシリボースの酸化は、親電子的な塩基プロペナールのような一連の安定な反応性産物を生じている。チミンプロぺナール(Tp;Thymine propenal)のような塩基プロペナール(図1)はα、β不飽和カルボニル基をもつ親核反応性であって、細胞内でミリモル(mM)レベルの高濃度で存在する低分子グルタチオン(GSH)のチオール基(SH)と反応する。
・下記アクロレイン骨格のβ位のプロトンの
位置に塩基をもつ化合物;例、右図
*2;Knutson CG, Wang H, Rizzo CJ, Marnett LJ (2007) Metabolism and elimination of the endogenous DNA adduct, 3-(2-deoxy-beta-D-erythropentofuranosyl)-pyrimido[1,2- alpha]purine-10(3H)-one, in the rat. J Biol Chem 282(50):36257–36264.
*3;M1dG =3-(2-deoxy-β-D-erythro-pentofuranosyl)pyrimido[1, 2-α]purin-10(3H)-one ;adduct arising from reaction of 2-deoxyguanosine(dG) with the endogenous electrophiles malondialdehyde and base propenals.
・本研究では、酸化的損傷DNAに由来するチミンプロペナール(Tp;Thymine propenal、図1)について、新しい酸化ストレスのバイオマーカーとして、多量の代謝物を検討し、主に胆汁と尿で容易に定量できる化合物を調べ、DNA損傷の代謝物として15種類の候補化合物をインビトロで同定した(図2)。
・システマティックな代謝物プロファイリングから、チミンプロぺナール(Tp)の代謝物が通常の3~4倍にも増加することを見出し、強力な炎症ならびに酸化ストレスのマーカーになり得ることを示唆している。以下に本研究での検討結果を示す。
図2、炎症と酸化ストレスのバイオマーカー候補;
・核酸塩基の代謝物プロファイル、チミンプロぺナール(図中、Tp.6)の15種の代謝物。DNA酸化による共通産物は、インビトロの実験で予測し、これらの内、7種はTp.6を処理したラットの尿と胆汁で検出された。
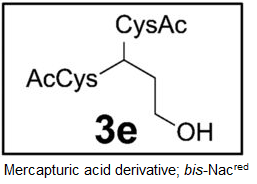
・尿への代謝物である化合物の3eは、生理食塩水で処理したラットでも観察され、酸化ストレスを負荷したラットでは、それが、3から4倍に増加していたので、ヒトでの炎症マーカーの強力な候補として示唆されている(図5)。
◆インビトロ及びインビボの代謝プロファイリングによるバイオマーカー候補の開発;
1)母型分子の代謝標的と反応部位のインシリコでの評価
2)バイオ変換した産物のインビトロ分析(図2、図3)
3)バイオマーカーとしての候補代謝物のインビボのバリデーション(LC-MS)(図4)
*LC-MS;クロマトグラフィー連動の質量分析法
◆インビトロ評価;
・まず第一に、化学反応性の原理および十分に特徴づけされた酵素代謝反応にもとづいて、Tp代謝物の分析を行った。
・チミンプロペナール(Tp.6)は塩基プロペナール(base propenal)であり、そのα,β不飽和カルボニル基とGSHとのコンジュゲーション、ならびにアルデヒド酸化還元酵素/脱水素酵素などによる代謝パスウエイで生じる潜在的な一連の反応産物をインビトロで検討した。
・Tp.6とGSHとのインビトロ反応における代謝プロファイリングを図3Aに示す。
・図3Bに示すように、その反応の結果、1a:M-GSH、2a:AE-GSH、及び3a:bis-GSHの3種の化合物が得られ、アルデヒド官能基の酸化・還元と同様に、十分に確立されたα,β不飽和カルボニル基の反応性が、直ちにGSHおよび炭素二重結合と他の親核基とのコンジュゲート型での候補となる代謝物が提示された。
図3、チミンプロぺナール(Tp.6)とグルタチオン(GSH)とのインビトロ反応;
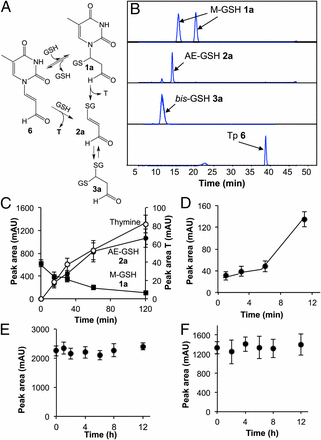 A;Tp6のGSHによるインビトロ反応における代謝プロファイリング;グルタチオン結合代謝物の化学構造;1a:M-GSH、2a:AE-GSH、及び3a:bis-GSH
A;Tp6のGSHによるインビトロ反応における代謝プロファイリング;グルタチオン結合代謝物の化学構造;1a:M-GSH、2a:AE-GSH、及び3a:bis-GSH
B;LC-MS/MS分析;1a、2a 及び3aとTp6、イオンクロマトで分離・抽出
C–F;HPLC分析
C,D;1a:M-GSHの2a:AE-GSHおよびthymineへの変化、3a:bis-GSHの2a:AE-GSH (D:formation of 2a) への変化
E,F;2a:AE-GSH (E)とTp 6(F)は分解に対して安定
In vitro反応;37℃、50mMリン酸緩衝液、pH7.4、1hr。Tp6;0.1mM、GSH;1mM
◆インビボ評価;
・次に、TpとGSHとの反応をラット肝臓抽出物のミクロゾーム分画で検討した。その反応は、インビトロの直接反応と似たスペクトラム産物を生じた(データ;省略)。
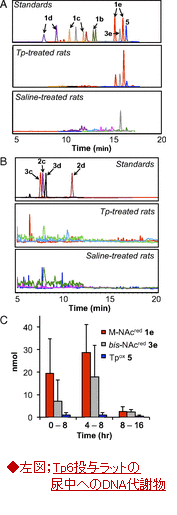
・Tp処理したラットの尿と胆汁中でのTp代謝物の同定;Tp代謝物を頸動脈にカテーテルを挿入して静脈内投与を行い、投与後8時間以内に、尿では図2に示した15種の標的化合物のうち、メルカプツリック酸の誘導体である1e:M-NAcred、3e:bis-NAcred 及びTp酸化物である化合物:5が代謝されていた(図4左図(A~C)、胆汁中への排出代謝物は割愛)。
図4、全身性の酸化ストレスとDNAの酸化代謝物;
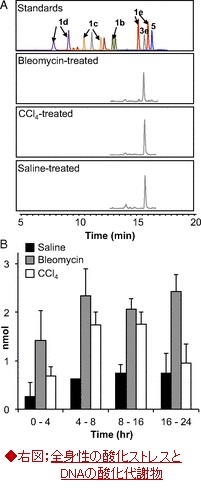 ・食塩処理したラットに、ブレオマイシン(bleomycin)、或は四塩化炭素(CCl4)を腹腔内投与し、4時間間隔で、その尿をドライアイス上に集め、続いてHPLCで極性の強弱によって分画して分け、最後に各分画中の15種の代謝物候補の化合物をLC-MS/MS MRMによって分析した。
・食塩処理したラットに、ブレオマイシン(bleomycin)、或は四塩化炭素(CCl4)を腹腔内投与し、4時間間隔で、その尿をドライアイス上に集め、続いてHPLCで極性の強弱によって分画して分け、最後に各分画中の15種の代謝物候補の化合物をLC-MS/MS MRMによって分析した。
A;投与後4~8時間で集めたサンプルの結果;
Tp代謝物でみられたのは、唯一bis-NAcred 3e,であった。未処理のラットでも観察された。
B;LC-MS/MS分析によるbis-NAcred 3eの定量;
外部キャリブレーションカを用いて、ブレオマイシン(灰色)、CCl4 (白色)処理したラット尿中の3eは、コントロールの食塩処理したラット尿(黒色)に比べて、3~4倍に増加している。データ;平均値(n=2)。
・酸化ストレスのバイオマーカーとしてのTp代謝物;
・広範な炎症と仮説をテストするために、酸化ストレスを引き起こす毒物として四塩化炭素、或いは、DNAを切断する抗がん剤ブロメライシンをラット腹腔内に投与して、塩基性プロぺナールの動向を調べた。
・図4(右図、A,B)の尿サンプルの分析結果は、食塩、ブロメライシン及び、四塩化炭素処理したラットの尿において検出されるたのが、唯一の代謝物bis-NAcred 3e(図1)であったことが明らかとなり、その尿中レベルがブロメライシン及び、四塩化炭素処理したラットで、食塩水処理したラットより、3~4倍高いことが示された。
・このラットの尿および胆汁におけるbis-NAcredのレベルの増加は、ストレスによるDNA損傷の結果を示唆しており、Tp代謝物の証拠として、尿および胆管排出物として多様なTp代謝物の検出は、バイオマーカーとして有効であることを示唆している。
(補足)
・Tp化合物の母型は、血液、尿、胆汁いずれでも検出されないが、Tpの主要代謝物の1つはストレスのないラット尿でバックグランド排出物として出現している。
・インビボ、インビトロ分析の結果、本研究では15種の代謝候補物に直面し、肝臓と腎臓でのGSHコンジュゲートであるCysGly、Cysとメルカプトウリッツ酸(Mercapturic acid)誘導体へのプロセッシングが予測される。
・Tpの反応性α,β不飽和カルボニル基の構造が、インビボ、インビトロで産生されたすべての代謝物で消失していた事実は、生理的代謝における無毒化が機能していることを証明している。
図5、チミジンプロペナール(Tp6)の代謝パスウエイ仮説;
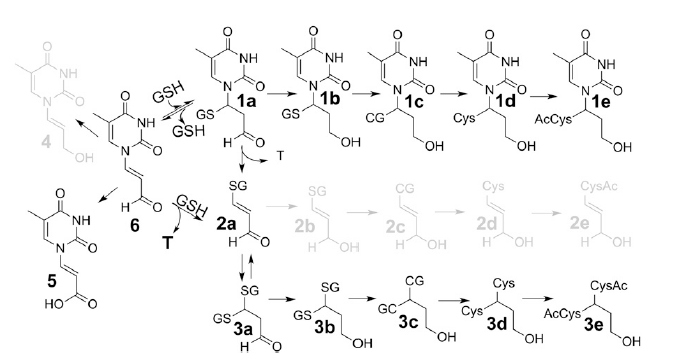 インビトロの反応から推定したTp代謝化合物;15種類の内、5種類(灰色で示した化合物;4、2b、2c、2d、2e)はTp処理又は酸化的ストレスを加えたラット尿或は胆汁中に検出されなかった。しかし、12種類の代謝物(黒色)はTp処理したラット尿あるいは胆汁中に観察された。これら12種の代謝化合物の内、bis-NAcred 3eは未処理ラットの尿中に内在性の塩基プロペナールとして見出され、かつ酸化ストレスで増加していた。
インビトロの反応から推定したTp代謝化合物;15種類の内、5種類(灰色で示した化合物;4、2b、2c、2d、2e)はTp処理又は酸化的ストレスを加えたラット尿或は胆汁中に検出されなかった。しかし、12種類の代謝物(黒色)はTp処理したラット尿あるいは胆汁中に観察された。これら12種の代謝化合物の内、bis-NAcred 3eは未処理ラットの尿中に内在性の塩基プロペナールとして見出され、かつ酸化ストレスで増加していた。
(考察)
・局所および全身性の酸化ストレスならびに炎症は、反応性化学種(reactive chemicals)を生じる。これら化学種はすべての細胞性分子にダメージを引き起こし、その病態はメカニスティックに疾患にむすびついている。
・顕著な例外として、筋の過酸化酵素由来の傷害ではCRPが全身性の炎症、および心臓疾患リスクのマーカーであるが、損傷分子はこれらストレスの有意なバイオマーカーとして出現しない。完全なバイオマーカーとならないのは、CRPが炎症と疾患との関連で不明だからである。
・一方、DNA損傷は、炎症と酸化ストレス及び疾患を起こす変異メディエーターとしてがんにより密接にリンクしている。
・Marenttらの例*2(外部から注入したM1dG化合物の代謝)に倣い、DNA酸化の共通産物であるDNA糖鎖部分の酸化によって生じる塩基プロペナールの代謝プロファイリングの原理を適用し、図5に示すオーバーオールの代謝フレームワークにみられる尿と胆汁への多様な代謝物の分泌を見いだした。
・図4のラットのインビボ投与でみられた代謝産物3e(図5)では3~4倍高値となっており、有用な酸化ストレスのバイオマーカーに成り得ることを示唆している。ヒトの尿での検証データが望まれる。
以上