これまで、「検査技術の発展」と称して、診断・検査にまつわる主な技術①~⑤を、その技術背景やエポックなど、順を追って紹介してきました。些少なコラムでしたが、検査技術の進歩に、その時々の「最先端の科学技術」が如何に重要な役割を果たしてきたかを、お伝えできれば幸いと思っております。
今回は、ノーベル賞の対象ではありませんでしたが、検査技術の進歩に画期的貢献をしたと思われる化学発光技術を紹介したいと思います。
◆化学発光
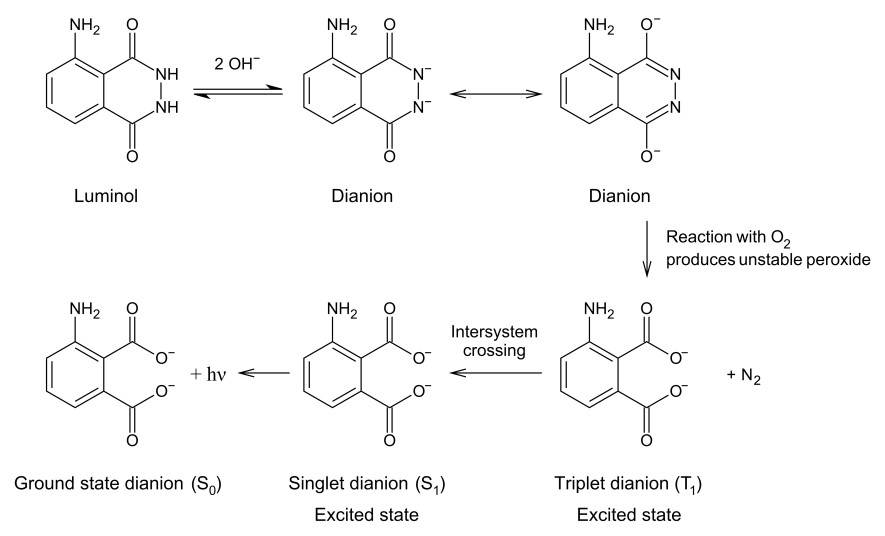
・化学発光は、科学捜査など身近に知られており、血痕判定のルミノール反応(図1)が高感度な発光測定法として使われていることは御存じの通りです。さらに、ホタルやヤリイカなどで知られている生物発光は、酵素ルシフェラーゼの反応に基づいております。
図1、ルミノール反応
アルカリ性水溶液中、ルミノール(Luminol)は過酸化水素 (H2O2) と反応して強い紫青色(460 nm)の発光(図1右)を示す。https://upload.wikimedia.org/wikipedia/commons/7/77/Luminol_chemiluminescence_molecular_representation.svg
◆検査薬における化学発光;
・検査薬では、標的(ターゲット)を検出する機能を最大限に発揮させる為、検査の試薬構成の要件を吟味し、改善することが大切なので、いつもイノベーションが求められています。具体的には、測定対象物を、短時間に、かつ高感度に検出できる技術を確立することです。その観点で、臨床検査のターゲットとなる各種タンパク質、核酸などを検出する手段として、免疫学的測定法が成果を挙げてきております。これまで、放射性同位元素を用いたRIA法から、取扱いが、より簡便で安全なELISA法、EIA法へと進展してきました。さらに、従来のELISA法、EIA法のシグナル検出系が比色系やケイ光系であったのを、新たな化学発光系へ変えることによって、検出シグナルの増強が可能となり、感度アップが図られてきました。
◆化学発光法による検査市場;
・表1に2012年のイムノアッセイ診断薬(免疫血清検査薬)市場を掲載しました。その市場規模1640億円のうち、製品化されている化学発光法の市場は約半分に相当する46%の762億円を占めております(富士経済2013)。
◆化学発光の技術;化学発光イムノアッセイ
化学発光イムノアッセイには、1)発光化合物を標識体として抗体に結合させた測定法、例えばアクリジニウムエステル(AE;acridinium ester)のような化合物を、直接抗体に標識して用いる化学発光イムノアッセイ(CLIA)、2)発光化合物を抗体に標識された酵素の基質として用いる測定法、即ち発光化合物が酵素によって分解されることで発光する化学発光酵素イムノアッセイ(CLEIA)などがあります。
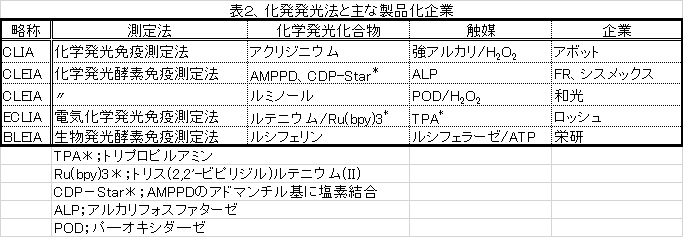
主な化学発光に基づくイムノアッセイ法を表2に示しましたように、現在、発光化合物は試薬として、自動測定装置とともに供給され、臨床検査で広く使われております。
(1)標識体として;
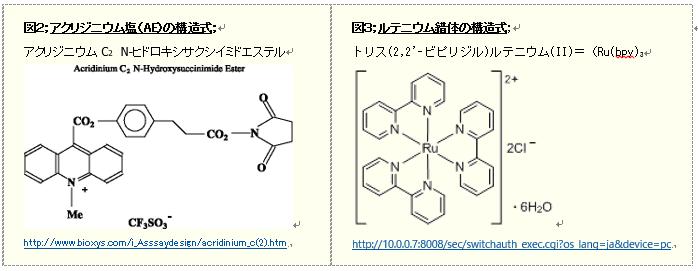
・1964年頃、AE塩のフェニルエステルがアルカリ性の過酸化物によって化学発光を生じること*1が示されました。 当初、AE化合物を標識体として着目したイムノアッセイへの適用*2が試みられましたが、エステル結合が加水分解するため非常に不安定なことが課題となりました。その後、ヒトα1フェトタンパクの測定系において、アクリジニウムエステル化合物(図3)を標識した抗体を用いた安定なイムノアッセイ系*3が開発され、その検出感度はアトモル(約8 X 10-19 mol)レベルと極めて高い測定系となりました。
・また、標識化合物としてルテニウム/トリス(ビピリジン)ルテニウム(II)錯体(図4)を用いたイムノアッセイが遅延発光法として用いられております。この発光は電極反応に伴う電子の電荷移動エネルギーを発光エネルギーとしており、電極荷電による酸化とトリプロピルアミンでの還元反応により励起発光を繰り返す測定法であり、電気化学発光法とも呼ばれています。
(2)酵素の基質として;
・1968年、過酸化分物1,2-ジオキセタン類がホタルを含む種々の生物発光反応の高エネルギー中間体であろうと提唱*4されましたが、この中間体は不安定で単離されておらず分光学的な観測はされていませんでした。後に下村博士が酸素(18O)の標識実験によって生物発光反応の中間体であることを証明しました*5。
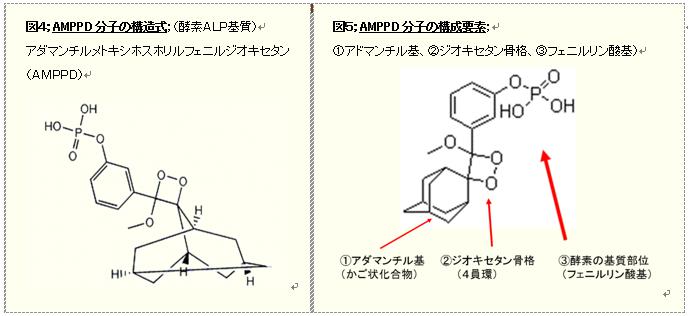
・1972年、アダマンタン系の立体障害をもつアルケン類から光酸化によって、極めて安定なジオキセタン類が合成*6されましたが、この異常に安定な過酸化物は、化学発光を起こすのに150-250℃の高温加熱が必要で、実用的ではありませんでした。 やがて、1989年、米国ブロンスタイン博士によって、EIA法で汎用されている酵素、アルカリフォスファターゼ(ALP)の基質として、ユニークなジオキセタン化合物のアイデアが提案され、ALP基質としてAMPPD(図4)が発明*7されました。ボストンのポラロイドで研究していたブロンスタイン博士は、高エネルギーを潜在的に保有する4員環ペルオキシドの1、2-ジオキセタン骨格をもつAMPPDを用いたCLEIA法およびホスファターゼ活性測定法を開発しました*8。
・このAMPPDは発光エネルギーを蓄えている4員環のジオキセタン骨格を含めて、3つの部分(図5)、即ち①アドマンチル基、②ジオキセタン骨格、③フェニルリン酸基から構成されています。かご状化合物でバルキーなアドマンチル基は、不安定な4員環ジオキセタン骨格の分解を抑制しており、フェニルリン酸基はALPの酵素基質となる部分です。
・その発光の概略は、まず、ALPによってリン酸基が切断されると、フェニル基の酸素アニオンが発光トリガーとなります。このメタ位の酸素アニオンから4員環へ電子シフトし、歪んでいる4員環のジオキセタン骨格が分解して、フェニル基へ高エネルギー移動が起こり、励起一重項状態になって、最終的にフェニル基から光が放射されて発光となります。
(3)増感剤(エンハンサー)の発見;
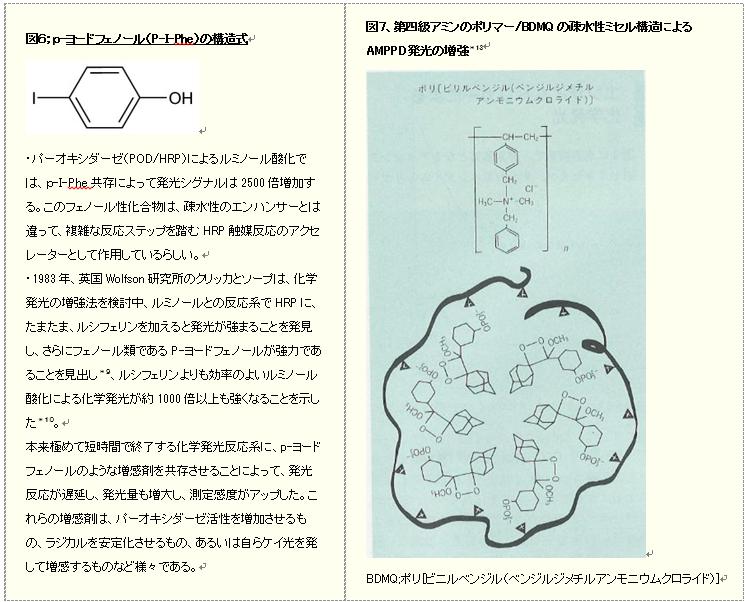
・化学発光法が検査の測定に適用されたのは、1983年に発光を強める増感剤(エンハンサー;Enhancer)の発見9,10)が寄与しております。パーオキシダーゼ触媒によるルミノールなどの発光アッセイには限界がありましたが、パラヨードフェノール(図6)のようなフェノール類がペルオキシダーゼ/ルミノール/過酸化水素による化学発光を増感することが報告されてから、多くの改良法が報告されECL(enhanced chemiluminescence)と呼称されています。ECLは医生化学や分析生化学において、高感度で迅速な検出方法11,12)となっており、AFPやサイロキシンなどのイムノアッセイに応用されて著しい感度アップが達成されております。
・このような化学発光における増感効果は、先に述べた化学発光基質AMPPDにおいても存在し、図7に示す第四級アミンのポリマーであるBDMQ/ポリ[ビニルベンジル(ベンジルジメチルアンモニウムクロライド)])の共存下で、AMPPDの化学発光は著しく増強されます。おそらくBDMQによってミセル様の分子集合体が形成され、疎水性の高い環境を与える*13ことで、AMPPDの発光量子収率が増加したためと推測されます。但し、バックグランドも増加するので、S/Nでみた実際の感度は数オーダーのアップとなり、臨床検査で使用されているCLEIA法による測定項目で、十分な高感度化*14が達成されています。
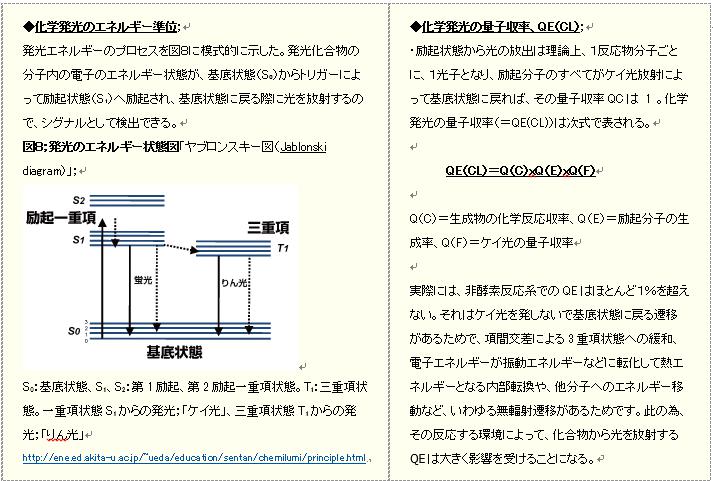
参考;化学発光のエネルギーと量子収率(QE);
===================================
*1;McCapra, F. et. al., Tetrahedron Lett. vol. 43, pp. 3167-3172,1964 & Rahut et al. J. Org. Chem、301, 3587-3592.1965.
*2;Simpson, J.S.A. et al., Nature 279,646-647,1979.
*3; Weeks I, Beheshti I, McCapra F et.al.,: Acridinium esters as high specific activity labels in immunoassay. Clin. Chem. 29: 1474 – 1479, 1983
*4;McCapra F;Chem.Commun,155,1968.
*5;Shimomura O& Johnson FH;Photochem.Photobiol.30,89,1979.
*6;Wieringa JH,et al.;Tetrahedron Lett.169、1972.
*7;Bronstein I, et al., J. Biolumi. Chemilumi.,;4, 99-111,1989.、A. P. Schaap et al., Tetrahedron Lett., 28, 1159-1162,1987.、米国特許出願第889823号
*8;Thorpe GH,et al.(Bronstein);Chemiluminescent enzyme immunoassay of alpha-fetoprotein based on an adamantyl dioxetane phenyl phosphate substrate.;Clin Chem 35(12), 2319-2321, 1989.
*9; Whitehead TP et al..(Kricka);Enhanced luminescence procedure for sensitive determination of peroxidase-labelled conjugates in immunoassay;Nature 305, 158-159,1983.
*10;Thorpe GH et al..(Kricka);Phenols as enhancers of the chemiluminescent horseradish peroxidase-luminol-hydrogen peroxide reaction: application in luminescence-monitored enzyme immunoassays. Clin Chem. 31(8),1335-41. 1985.
*11;Kricka LJ & Thorpe, GH ;Chemiluminescent and bioluminescent methods in analytical chemistry
Analyst 108, 1274.1983.
*12;Kricka LJ et al..;Enhanced chemiluminescence enzyme immunoassay;Pure Appl. Chem. 59, 651,1987,
*13;岡田;アドマンタン系(技術解説II、発光系);臨床検査、38(2),209-214,1994.
*14;Nishizono I et.al., Rapid and sensitive chemiluminescent enzyme immunoassay for measuring tumor markers. Clin Chem. 37,1639-44. 1991.
===================================
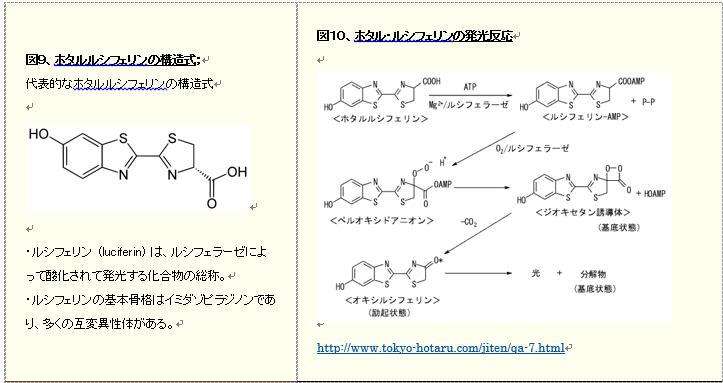
補足1;生物発光(図9、10)
・酵素ルシフェラーゼによる生物発光の量子収率は0.8以上といわれており、非常に高いので有望な選択肢となりうるので、リコンビナントのルシフェラーゼ開発が挑戦されている。実用化されている生物発光法には表2に示す栄研の製品がある。
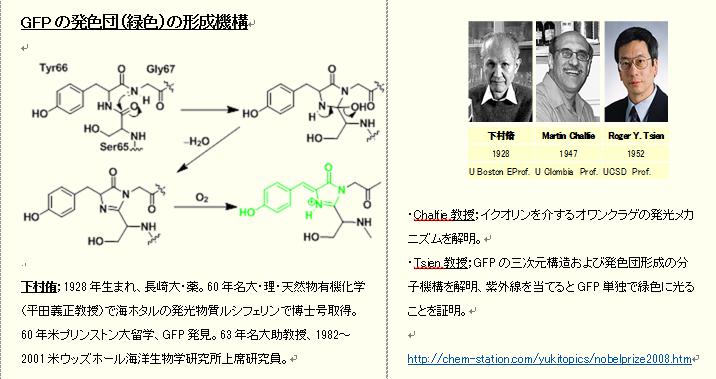
補足2;生物発光のGFPタンパク発見
今日、ケイ光タンパク質GFP(Green fluorescent protein;分子量27 kDa)は、生化学や分子細胞生物学などの研究分野で、基本的な検出用タンパクとして日常的に汎用されている。
・オワンクラゲのGFPはタンパク質のエクオリン(aequorin)と複合体を形成しており、ともに働いて発光する。 その際、オワンクラゲの発色細胞内でGFPは近紫外光(397nm)を吸収して、緑色の可視光(509nm)を放射する。即ち、エクオリンが吸収したエネルギーを青色ケイ光として放出し、これをGFPが受け取って緑色に光る。
・GFPは励起光を当てると単体でも発光し、酸素は必要だが発光するのに外部因子が不要というユニークな性質を持っている。下村博士はオワンクラゲからGFP自体を発見して単離した。この発見によって、Chalfie、Tsienらとともに2008年ノーベル化学賞を受賞した。http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2008/shimomura-facts.html
以上